Molécula de ácido fórmico
Molécula de etáno
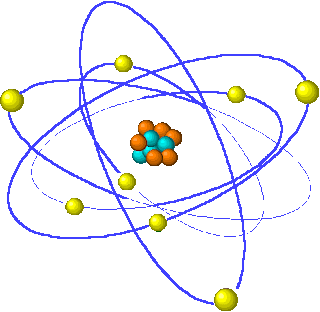
Modelo del átomo de helio
ISOTOPOS
Los átomos constan básicamente de tres tipos de partículas: protones, electrones y neutrones y lo que confiere las características propias de cada elemento es el número de protones que tiene cada uno de sus átomos.
Frederick Soddy (1877-1956) en 1910 introdujo el término de isótopo para denominar átomos que difieren en su masa atómica aunque tienen el mismo número de protones.
FORMACIÓN DE IONES
Si un átomo o molécula tiene la fuerza de atracción suficiente para hacerse de uno o varios electrones adicionales, queda cargado negativamente. A los átomos o moléculas con carga eléctrica se les denomina iones.
A los iones positivos se les llama cationes, y a los iones negativos, aniones.


.jpg)
.jpg)